TEMA: OXIGENO SOBRE LOS ELEMENTOS
Introducción
La importancia del oxígeno en el proceso de
reacción con metales y no metales, así como el cambio de éstos en presencia de
agua. Dicho proceso, conocido como oxidación, lo podemos observar en las
tuberías, en la herrería y es relevante en las industrias de la construcción y
marítima, ya que ésta última tiene un gasto de millones de pesos al año para
combatirla. La oxidación también tiene que ver con la combustión que usamos a
diario al calentar alimentos en la estufa ó el agua para bañarse, así como la
que ocurre en el motor de los automóviles y, en la síntesis de algunos
medicamentos.
Reacciones de oxígeno
El oxígeno es el elemento más abundante en el planeta Tierra, constituye
aproximadamente el 50% en masa de la corteza terrestre y forma el 21% en volumen
de la atmósfera; es componente activo del aire, se encuentra presente en el
agua y como óxidos con otros elementos.
Todo fenómeno químico puede ser representado a través de una ecuación
química, que nos muestra los cambios que se llevan a cabo, así podemos
describir las variaciones que se realizan cuando se oxidan los elementos
metálicos y no metálicos en presencia de oxígeno y con el auxilio de la energía
calorífica.
Reacciones con los metales
Un ejemplo de las reacciones del oxígeno con un metal, es la que ocurre
con el magnesio al someterlo a la reacción de oxidación en una flama, pues
desprende una intensa luz blanca y se convierte en un sólido blanco muy frágil;
el producto de esta reacción es un óxido metálico llamado óxido de magnesio.
2Mg(s) + O² (g) ─ 2MgO(s) + E
El producto final tiene un coeficiente 2 precediendo a la fórmula
MgO, ésta es la fórmula mínima del óxido del magnesio, si se considera
que la fórmula se escribe como el resultado del entrecruzamiento de valencias,
en el ejemplo (2+) para el magnesio (Mg) y (2-) para el oxígeno (O), se
representa la fórmula como Mg2O2 entonces; al escribir las fórmulas, se
considera la expresión mínima a través de su mínimo común divisor, en este caso
al dividir 2/2=1, la fórmula de un compuesto tiene que ser eléctricamente
neutra, esta condición se cumple para el óxido de magnesio MgO (2+)(2-)= 0.
Reacción con los no metales
Todo cambio químico puede ser descrito a través de una ecuación que nos
muestra las transformaciones que ocurren cuando interactúan dos o más
sustancias entre sí. De esta forma podemos describir las variaciones que se
realizan cuando se oxidan los elementos no metálicos en presencia de oxígeno y
con el auxilio de la energía calorífica. Se puede tomar como ejemplo el
carbono, cuando éste es sometido a la reacción de oxidación en la flama, se
lleva a cabo su combustión y se desprende un gas llamado monóxido de carbono,
en el caso de su valencia de menor valor; en la otra posibilidad cuando la
valencia de intercambio del carbono es la mayor, forma el dióxido de carbono.
En ambas reacciones hay desprendimiento de energía, el producto de estas
reacciones son óxidos no metálicos.
2C + O² ─ CO + CO (monóxido de carbono)
Se nota que se forman dos moléculas de monóxido de carbono. La otra
posibilidad es cuando el carbono actúa con la valencia de 4+, como se muestra
enseguida:
C + O² ─ CO² (molécula de dióxido de carbono)

Ejercicio de completar la tabla
a tráves de los conocimientos obtenidos en esta sección.
|
Reacciones de óxido con agua
Después de la formación de los óxidos correspondientes tanto metálicos como no metálicos, es factible combinarlos con agua para formar nuevos compuestos. En el caso de los óxidos metálicos cuando interactúan con agua forman hidróxidos. Tomando como ejemplo el magnesio, se observa lo siguiente.
El óxido de magnesio en presencia de agua forma el hidróxido de magnesio.
Después de la formación de los óxidos correspondientes tanto metálicos como no metálicos, es factible combinarlos con agua para formar nuevos compuestos. En el caso de los óxidos metálicos cuando interactúan con agua forman hidróxidos. Tomando como ejemplo el magnesio, se observa lo siguiente.
El óxido de magnesio en presencia de agua forma el hidróxido de magnesio.
MgO + H²O ─ Mg(OH)²
Los óxidos no metálicos en presencia de agua forman ácidos del tipo oxiácido.
Por ejemplo en el dióxido de carbono o anhídrido carbónico al reaccionar con agua, produce una molécula de ácido carbónico.
CO² + H²O ─ H²CO³ (ácido carbónico)
Se suman la cantidad de elementos que intervienen en la síntesis de los ácidos, empezando por la calidad ácido representado por los hidrógenos, después el no metal y finalmente la cantidad de oxígenos que intervienen en la esquematización simbólica de la reacción para formar ácidos.
Para escribir la fórmula de un hidróxido tienes que anotar primero el catión, en este caso el metal, después el anión, es decir, el hidróxido y por último fijarte en las valencias que les corresponden.
El OH tiene 1-.
El Li tiene 1+, Ca 2+, Al 3+
Para que el compuesto sea neutro tiene que haber tantas cargas negativas como positivas, al entrecruzar las valencias se representan las fórmulas eléctricamente neutras.

Ejercicios de completar la tabla a
través de este tema y los conocimientos obtenidos de este.
|
Reglas de nomenclatura
Es un conjunto de reglas que se aplican para nombrar y representar con
símbolos y fórmulas a los elementos y compuestos químicos. Actualmente se
aceptan tres sistemas de nomenclatura donde se agrupan y nombran a los
compuestos inorgánicos:
·
Sistema de nomenclatura sistemático de la Unión Internacional de Química
Pura y Aplicada(IUPAC).
·
Sistema de nomenclatura funcional, clásico ó tradicional.
·
Sistema de nomenclatura Stock.
Óxidos metálicos
Resultan de la combinación del oxígeno con metales y al reaccionar con
el agua producen bases.
metal + oxígeno ─ óxido metálico o
básico
Nomenclatura Stock
Se nombra con la palabra genérica óxido seguido de la preposición de
enseguida el nombre del metal con el que se combinó, por ejemplo: óxido de
calcio.
Ca+² + O-² ─ Ca²O²
En este ejemplo hay posibilidad de obtener el mínimo común divisor entre
los valores por lo que se obtiene: CaO -óxido de calcio-.
Ca+² + O-² ─ CaO
Cuando el metal presenta más de una valencia se nombran con la palabra
genérica óxido seguida de la preposición de y después el nombre del metal,
escribiendo entre paréntesis con número romano el valor de la valencia.
Nomenclatura clásica o tradicional
Estos mismos compuestos se pueden nombrar con la palabra genérica óxido
seguida del nombre del metal con el sufijo oso para el valor menor de la
valencia y con el sufijo ico cuando el valor de su valencia es mayor, por
ejemplo:
Ni+² O-² con menor valencia formará
NiO y se nombrará óxido niqueloso
Ni+³ O-² con mayor valencia formará
Ni²O³ y se nombra óxido niquélico
Nomenclatura IUPAC
La IUPAC determina que estos compuestos se nombran a partir de la
cantidad de elementos que los constituyen, por ejemplo:
NiO se nombra Monóxido de níquel y el Ni2O3 Trióxido de diníquel.
Óxidos ácidos
Son combinaciones del oxígeno con un no metal y al reaccionar con agua
producen ácidos del tipo oxiácido.
no metal + oxígeno ─ +oxido no
metálico u óxido ácido
Nomenclatura Stock
Se nombra con la palabra óxido seguida de la preposición de, a
continuación el nombre del no metal expresando con número romano el valor de la
valencia con la que interactuó con el oxígeno, por ejemplo:
C+² O-² ─ CO (óxido de carbono II)
C+4 O-2 ─ CO² (óxido de carbono IV)
Nomenclatura clásica ó tradicional
Este mismo tipo de compuestos, también se pueden nombrar con la palabra
genérica anhídrido seguida del nombre del no metal con el sufijo oso para el
valor de la menor valencia e ico para el valor de la mayor valencia, por
ejemplo:
CO es anhídrido carbonoso
CO² es anhídrido carbónico
Cuando el no metal presenta más de dos valencias como es el caso del
cloro se conservan los sufijos de la regla anterior y se utilizan además: el
prefijo hipo proveniente del griego "hypo" que significa inferior o
debajo, y el prefijo hiper o per del griego "hyper" que significa
mayor o superior, por ejemplo:
Cl+1 O-² ─ Cl²O es anhídrido
hipocloroso
Cl+³ O-² ─ Cl²O³ es anhídrido cloroso
Cl+5 O-² ─ Cl²O5 es anhídrido clórico
Cl+7 O-² ─ Cl²O7 es anhídrido
perclórico
Nomenclatura IUPAC
Este tipo de compuestos se nombran a partir de la cantidad de elementos
que constituyan a su representación simbólica, empleando las raíces griegas de
los números correspondientes, por ejemplo:
CO monóxido de carbono
CO² dióxido de carbono
Cl²O³ trióxido de dicloro
Cl²O5 pentóxido de dicloro
Hidróxidos
Una de las principales aplicaciones de las bases o hidróxidos es en la
fabricación de los jabones que usamos a diario en casa. Se forman por:
óxido metálico + agua ─ base o
hidróxido
Nomenclatura Stock
Cuando ya se tiene un óxido metálico, al combinarse con agua forma un
hidróxido, también conocido como base, por ejemplo:
NiO + H²O ─ Ni(OH)² (hidróxido
de níquel II)
NiO³ +H²O ─ Ni(OH)³ (hidróxido de
níquel III)
Nomenclatura clásica ó tradicional
Se conserva la misma nomenclatura para nombrar a los compuestos
derivados de los óxidos metálicos formando los hidróxidos correspondientes y
también se conservan los sufijos “oso” para el valor menor de la valencia e
“ico” para el valor mayor, por ejemplo:
Ni(OH)² es hidróxido niqueloso
Ni(OH)³ es hidróxido niquélico
Nomenclatura IUPAC
Se conserva la misma nomenclatura, es decir, considerando la cantidad de
elementos que constituyen el compuesto, por ejemplo:
Ni(OH)² es dihidróxido de níquel
Ni(OH)² es trihidróxido de níquel
Ácidos
Cuando se tiene un óxido no metálico, al combinarse con agua forma un
ácido de tipo oxiácido, se llaman oxiácidos porque en su composición está
presente el oxígeno y la calidad ácida será determinada por la presencia del
hidrógeno.
óxido no metálico + agua ─ ácido
(oxiácido)
Nomenclatura Stock
Se nombra al no metal con el sufijo ato, seguida del valor de la
valencia del no metal y por último se agrega de hidrógeno.
CO + H²O ─ H²CO² carbonato (II) de
hidrógeno
CO² + H²O ─ H²CO³ carbonato (IV) de
hidrogeno
Nomenclatura clásica ó tradicional
Cuando los óxidos no metálicos se combinan con agua por síntesis o
adición forman su ácido correspondiente, derivando su nombre del anhídrido del
cual provenían, se pierde la palabra anhídrido, se cambia por ácido y conserva
el nombre del anhídrido originario.
Por ejemplo, para formar los ácidos correspondientes del carbono, se
parte de su óxido o anhídrido en presencia de agua, reaccionan y se produce:
CO + H²O ─ H²CO² es ácido carbonoso
CO² + H²O ─ H²CO³ es ácido carbónico
Nomenclatura IUPAC
Se conserva la misma nomenclatura, es decir, considerando la cantidad de
elementos que constituyen el compuesto, por ejemplo:
CO + H²O ─ H²CO² es dioxicarbonato
(II) de dihidrogeno
CO² + H²O ─ H²CO³ es trioxicarbonato
(IV) de dihirogeno
Hidrácidos
Este tipo de compuestos se forman con la combinación de un hidrógeno
(H+) como ión positivo y un no metal (NM-) como ión negativo.
H+ + NM- ─ HNM
Nomenclatura Stock
Se nombran con el nombre del no metal con sufijo uro seguida de la
preposición de y finalmente la palabra hidrógeno, en estado natural. Por
ejemplo:
H1+ F1- ─ HF se nombra fluoruro de
hidrógeno
Nomenclatura tradicional y de la IUPAC
En este caso convergen la nomenclatura clásica o tradicional y la de
IUPAC, en éstas se nombran con la palabra genérica ácido seguida del nombre del
no metal con el que se combinó y con el sufijo hídrico, en disolución acuosa,
por ejemplo:
H+ + Cl- ─ HCl se nombra ácido
clorhídrico
N²O5
|
Anhídrido nítrico
|
Óxido de nitrógeno (V)
|
Pentaóxido de dinitrógeno
|
FeO
|
Óxido ferroso
|
Óxido de hierro (II)
|
Monóxido de fierro
|
HClO
|
Ácido hipocloroso
|
Clorato (I) de hidrógeno
|
Monoxoclorato de hidrógeno
|
Al2O3
|
Óxido alumínico
|
Óxido de alumino
|
Trióxido de dialuminio
|
Co²O3
|
Óxido cobáltico
|
Óxido de cobalto (III)
|
Trióxido de dicobalto
|
H²SO4
|
Ácido sulfúrico
|
Sulfato(VI) de hidrógeno
|
Teraoxosulfato (VI) de hidrógeno
|
Na²O
|
Óxido sódico
|
Óxido de sodio
|
Óxido de disodio
|
Ba(OH)²
|
Hidróxido de bario
|
Hidróxido bárico
|
Hidróxido de bario
|
I²O5
|
Anhídrido yódico
|
Óxido de yodo(V)
|
Pentaóxido de diyodo
|
HBr
|
Ácido bromhídrico
|
Ácido bromhídrico
|
Bromuro de hidrógeno
|
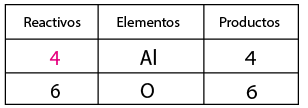
Balanceo
El balanceo consiste en igualar el número de átomos de cada elemento tanto en los reactivos como en los productos, y sirve para verificar la Ley de la Conservación de la Materia (La materia no se crea ni se destruye solo se transforma).
El balanceo consiste en igualar el número de átomos de cada elemento tanto en los reactivos como en los productos, y sirve para verificar la Ley de la Conservación de la Materia (La materia no se crea ni se destruye solo se transforma).
Reactivos ─ Productos
Al + O² ─ Al²O³
Para llevarlo se tienen las siguientes reglas:
Contar el número de elementos existentes en dicha ecuación de lado de los reactivos y del lado de los productos, empezando por: metales, no metales, dejando para el final al oxígeno e hidrógeno (en caso de que la ecuación los contenga).
Al hacer el conteo de cada lado, se recomienda indicar con coeficientes la igualación de la cantidad de átomos de los elementos que intervienen en la representación de una reacción química, por ejemplo:
Contar el número de elementos existentes en dicha ecuación de lado de los reactivos y del lado de los productos, empezando por: metales, no metales, dejando para el final al oxígeno e hidrógeno (en caso de que la ecuación los contenga).
Al hacer el conteo de cada lado, se recomienda indicar con coeficientes la igualación de la cantidad de átomos de los elementos que intervienen en la representación de una reacción química, por ejemplo:
Se aprecia la presencia de un aluminio de lado de los reactivos y dos del lado de los productos, por lo que es necesario colocar un coeficiente de dos en el aluminio del lado de los reactivos para igualar la cantidad del metal aluminio en ambos lados de la ecuación.
A continuación contar el no metal, oxígeno de ambos lados de la ecuación, por inspección se observa que del lado de los reactivos se requiere un coeficiente tres y de dos en el compuesto óxido de aluminio con el fin de igualar la cantidad de oxígenos tanto de reactivo como de producto.
Se contabiliza nuevamente el aluminio, observando que se alteró en cantidad de átomos de este elemento, por lo que ahora es necesario tener cuatro aluminios del lado de los reactivos en lugar de dos, con el fin de equilibrar la cantidad de átomos del elemento aluminio en reactivos y en productos.
Para comprobar la igualdad de la cantidad
de átomos de los elementos que intervienen en la representación de la reacción
química, se recomienda volver a contar la cantidad de cada uno de ellos.


Ejercicios de los conocimientos aprendidos en este tema.
Bibliográfia o referencia de consulta :http://portalacademico.cch.








No hay comentarios:
Publicar un comentario